धातुकर्म
Category :
धातुकर्म
विश्लेषणात्मक अवधारणा
यद्यपि वर्तमान धातुकर्मिकी की औद्योगिकी क्रांति के बाद व्यापार की वृद्धि हुर्इ फिर भी वर्तमान अवधारणाओं में से बहुत-सी ऐसी हैं जिनका आधार औद्योगिकी क्रांति के पहले से है। भारत में सात हजार वषोर्ं से भी अधिक समय से पारंपरिक धातुकर्मीय कौशल रहा है। पुरातन धातुविदों ने महत्वपूर्ण योगदान दिए हैं जिनको विश्व के इतिहास में उचित स्थान मिलना चाहिए। जिंक और अधिक कार्बन वाले स्टील तैयार करने में तो पुरातन भारत का महत्वपूर्ण योगदान है जिसने वर्तमान धातुकर्मीय प्रगति के लिए आधार तैयार किया । जिसके कारण धातुकर्म का अध्ययन आरंभ हुआ और औद्योगिक क्रांति आर्इ। धातुओं की आवश्यकता विभिन्न प्रकार के कायोर्ं के लिए होती है, अत: हमें उन खनिजों में से इनके निष्कर्षण की आवश्यकता होती है जिनमें यह पार्इ जाती है तथा जिनसे इनका निष्कर्षण वाणिज्यिक रूप से व्यावहारिक होता है। इन खनिजों को अयस्कों के नाम से जाना जाता है।
भूपर्पटी का संघटन
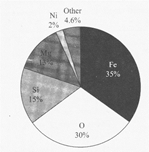
पृथ्वी में बहुत सारे तत्व पाए जाते हैं। पृथ्वी की सतह (भू-पपर्टी) में सबसे अधिक पाया जाने वाला तत्व ऑक्सीजन है। सभी तत्वों में धातुओं में पृथ्वी की सतह में सबसे अधिक धातु तत्व एल्युमीनियम उसके पश्चात लोहा उपस्थित रहता है। पृथ्वी की सतह (Earth Crust) में पाये जाने वाले विभिन्न तत्वों की प्रतिशतता के अनुसार-
|
तत्व व संकेत |
प्रतिशत |
|
ऑक्सीजन (O) सिलिकॉन (Si) एल्युमीनियम (AI) लोहा (Fe) कैल्शियम (Ca) सोडियम (Na) पोटेशियम (K) मैग्नेशियम (Mg) |
46.8 % 27.7 % 8.1% 5 % 3.6 % 2.8 % 2.6 % 2.1% |
§ सम्पूर्ण पृथ्वी में तत्वों की मात्रा-
§ सम्पूर्ण पृथ्वी में सबके ज्यादा धातु Fe - 35: एवं भूपपर्टी पर । सबसे ज्यादा धातु AI - 8.1% है।
धातुओं की उपस्थिति
प्रकृति में धातुएं निम्न दो अवस्थाओं में पायी जाती हैं
1. मुक्त अवस्था में- अक्रियाशील धातुएं, उत्कृष्ट धातुएं, जिनका विद्युत धनात्मक गुण का मान कम होता है, प्रकृति में मुक्त अवस्था में पायी जाती हैं। ये धातुएं जल, कॉर्बन डाइ-ऑक्साइड, ऑक्सीजन आदि से प्रभावित नहीं होती। उदाहरण - सिल्वर, गोल्ड, प्लेटिनम आदि।
2. संयुक्त अवस्था में- क्रियाशील धातुएं प्रकृति में अपने यौगिकों के रूप में उपस्थित रहती हैं। ये धातुएं जल, कॉर्बन डाय ऑक्साइड, ऑक्सीजन आदि से क्रिया करती हैं। उदाहरण- सोडियम, मैग्नेशियम, कैल्शियम, आयरन, कॉपर, जिंक, एल्युमीनियम आदि।
खनिज - वे रासायनिक पदार्थ हैं, जो अजैविक (अकार्बनिक) प्रक्रियाओं के द्वारा बनते है। अधिकांश धातुएं प्रकृति में अपने यौगिकों के रूप मे एवं अन्य अशुद्धियों के साथ चट्टानों की ऊपरी परतों में पायी जाती हैं, इन्हें खनिज (Mineral) कहते हैं।
आधात्री - खनिज में उपस्थित अशुद्धियां को आधात्री (Gangue or matrix) कहते हैं। इस प्रकार किसी धातु का यौगिक, जो प्रकृति में पाया जाता है, खनिज कहलाता है।
अयस्क (Ores) - वे खनिज, जिनमें किसी मुख्य धातु की मात्रा अधिकता में हो और उस खनिज से धातु का निष्कर्षण सरल एवं व्यापारिक रूप किया जाता है, अयस्क कहलाते हैं। सभी अयस्क, खनिज हैं परन्तु सभी खनिज अयस्क नहीं हैं क्योंकि सभी खनिजो से धातुओं को प्राप्त नही किया जा सकता है लेकिन अयस्कों से प्राप्त कर सकते हैं। प्रकृति में दो प्रकार के खनिज उपस्थित रहते हैं। धात्विक खनिज जिनमे धातु उपस्थित रहती है एवं अधात्विक खनिज जिनमें धातु अनुपस्थित रहती है।
कुछ महत्वपूर्ण धातुओं के अयस्क (Ores of Some important Metals) -
|
धातु |
अयस्क का नाम |
अयस्क का संगठन |
|
लीथियम \[_{3}Li\] |
स्पोड्यूमिन लेपीडोलाइट |
\[LiAlS{{i}_{2}}{{O}_{6}},\,\,k(Li,\,\]\[\,Al,\,\,Rb{{)}_{2}}{{(Al,\,\,Si)}_{4}}\]\[{{O}_{10}}{{(F,\,\,OH)}_{2}},\] |
|
सोडियम \[_{11}Na\] |
साधारण लवण (रॉक साल्ट) चिली साल्ट पीटर ग्लोबेराइट (ग्लोबर लवण) क्रायोलाइट सोडा ऐश |
NaCl\[NaN{{O}_{3}}\]\[N{{a}_{2}}S{{O}_{4}}.10{{H}_{2}}O\]\[N{{a}_{3}}AI{{F}_{6}}\],\[NaC{{O}_{3}}\] |
|
मैग्नीशियम \[_{12}Mg\] |
मैग्नेसाइट इप्सोमाइट (इप्सम लवण) डोलामाइट कार्नेलाइट टैल्क एस्बेस्टस |
\[MgC{{O}_{3}}\]\[MgS{{O}_{4}}.7{{H}_{2}}O\] \[MgC{{O}_{3}}.CaC{{O}_{3}}\] \[MgC{{l}_{2}}.KCl.6{{H}_{2}}O\] \[M{{g}_{3}}(S{{i}_{4}}O{{ & }_{10}}){{(OH)}_{2}}\] \[M{{g}_{3}}S{{i}_{2}}O{{ & }_{5}}{{(OH)}_{4}}\] |
|
पोटेशियम \[_{19}K\] |
सिल्वाइन नाइटर (साल्ट पीटर या शोरा) कार्नेलाइट स्कोनाइट
|
KCl \[KN{{O}_{3}}\] \[KCl.MgC{{l}_{2}}.6{{H}_{2}}O\] \[{{K}_{2}}S{{O}_{4}}\] |
|
कैल्शियम\[_{20}Ca\] |
जिप्सम लाइम स्टोन फॉस्फोराइट फ्लोरस्पार |
\[CaS{{O}_{4.}}2{{H}_{2}}O\] \[CaC{{O}_{3}}\] \[C{{a}_{3}}{{(P{{O}_{4}})}_{2}}\] \[Ca{{F}_{2}}\] |
|
क्रोमियम\[_{29}Cr\] |
क्रोमाइट |
\[C{{r}_{2}}{{O}_{3}}.FeO\] |
|
मैंगनीज\[_{29}Mn\] |
पायरोल्यूसाइट मैंगेनाइट |
\[Mn{{O}_{2}}\] \[M{{n}_{2}}{{O}_{3}}.{{H}_{2}}O\] |
|
कॉपर\[_{29}Cu\] |
कॉपर पाइराइट कॉपर ग्लास क्यूप्राइट (रूबी कॉपर) मैलेकाइट ऐजुराइट
|
\[CuFe{{S}_{2}}\] \[C{{u}_{2}}S\] \[CuC{{O}_{3}}.Cu{{(OH)}_{2}}\] \[2CuC{{O}_{3}}.Cu{{(OH)}_{2}}\] |
|
जिंक\[_{30}Zn\] |
जिंक ब्लैंडी कैलेमाइन विलेमाइट जिंकाइट (लाल जिंक ऑक्साइट) |
ZnS \[ZnC{{O}_{3}}\] \[ZnSi{{O}_{4}}\] ZnO |
|
सिल्वर\[_{47}Ag\] |
अर्जेन्टाइट (सिल्वर ग्लांस) रूबी सिल्वर (पाइरैजिराइट) हॉर्न सिल्वर |
\[A{{g}_{2}}S\] \[A{{g}_{2}}S.S{{b}_{2}}{{S}_{3}}\]
\[AgCl\] |
|
टिन \[_{50}Sn\] |
कैसिटेराइट (टिन स्टोन) |
\[Sn{{O}_{2}}\] |
|
मक्र्यरी \[_{80}Hg\] |
सिनेबार |
\[HgS\] |
धातुकर्म (Metallurgy)-
प्रकृति में उपस्थित धातुएं अपने शुद्धतम रूप में नही पार्इ जाती है। अर्थात किसी धातु का इसके अयस्क या धात्विक खनिज से शुद्ध रूप में निष्कर्षण धातुकर्म कहलाता है। धातु के निष्कर्षण की प्रक्रिया में उसका उपचार, अयस्क की प्रकृति, धातु तथा अशुद्धियों निर्भर करता है।
किसी तत्व के संयुक्त अवस्था से निष्कर्षण तथा पृथक्करण में रसायन के कर्इ सिद्धांत निहित होते हैं। फिर भी धातुओं के सभी निष्कर्षण प्रक्रमों के कुछ सामान्य सिद्धांत समान हैं। किसी अयस्क में केवल एक ही अभीष्ट पदार्थ होता है। यह सामान्यतया मृदा तथा अवांछित पदार्थो द्वारा संदूषित होता है, जिन्हें अपअयस्क (गैंग) कहा जाता है। अयस्कों से धातु के पृथक्करण तथा निष्कर्षण के लिए मुख्यत: निम्नलिखित पद हैं- अयस्क का सांद्रण, सांद्रित अयस्क से तत्व का पृथक्करण तथा धातु का शुद्धीकरण।
जल धातुकर्म- जटिल लवण बनाकर धातु का विस्थापन।
धातु शोधन- कच्ची या अपरिष्कृत धातु से शुद्ध धातु प्राप्त करना।
धातु निष्कर्षण -
किसी धातु के निष्कर्षण में प्रयुक्त विभिन्न प्रक्रियाएं निम्न प्रकार हैं-
1. तोड़ना तथा पीसना (Breaking and Grinding)- अयस्क के बड़े पत्थरों को पहले रोटेटर द्वारा छोटे टुकड़ों में तोड़ लिया जाता है और फिर बेलनों की सहायता से पीसकर चूर्ण बनाते हैं।
2. अयस्को का सान्द्रण (Concentration of Ores)- अवांछित पदाथोर्ंय जैसे- रेत, क्ले आदि का अयस्कों से निष्कासन का या पिसे अयस्क में से अशुद्धियों का पृथक्करण अयस्क प्रसाधन कहलाता है। इसके द्वारा धातु की प्रतिशतता निरन्तर बढ़ती जाती है, अत: इसे अयस्क का सान्द्रण भी कहते हैं। सांद्रण की क्रिया करने से पहले अयस्कों को श्रेणीकृत किया जाता है और उचित आकार में तोड़ा जाता हैं। इसमें कर्इ पद सम्मिलित होते हैं और इन पदों का चयन उपस्थित धातु के यौगिक एवं आधात्री (गैंग) के भौतिक गुणों में अंतर पर निर्भर करता है। धातु का प्रकार, उपलब्ध सुविधाओं तथा पर्यावरणीय कारकों का भी ध्यान रखा जाता है।
सान्द्रण- अयस्क में से अपद्रव्य के कणों को हटाने की प्रक्रिया सान्द्रण कहलाती है।
आधात्री- अयस्क में उपस्थित मिट्टी, रेत, कंकड़ आदि की अशुद्धियां।
झाग उत्प्लावन विधि- सल्फाइड अयस्कों का सान्द्रण तेल मिले हुए पानी द्वारा वायु के प्रवाह में किया जाता है।

सांद्रण की महत्वपूर्ण प्रक्रियाएं - (i) गुरुत्वीय पृथक्करण विधि, (ii) चुंबकीय पृथक्करण, (iii) फेन प्लवन विधि,
(iv) निक्षालन/प्रक्षालन - बॉक्साइट से एलुमिना का निक्षालन।
सांद्रित अयस्कों से अशोधित धातुओं का निष्कर्षण धातु निष्कर्षण के लिए सांद्रित अयस्कों को ऐसे प्रारूपों में परिवर्तित करना आवश्यक होता है जो कि अपचयन के लिए उपयुक्त हों।
निस्तापन- अयस्क को वायु की अनुपस्थिति में गर्म करके ऑक्साइड में बदलना।
भर्जन- अयस्क को वायु के आधिक्य में गर्म करके ऑक्साइड में बदलना।
प्रगलन- धातु ऑक्साइडों को उचित अपचायक के साथ गालक की उपस्थिति में गर्म करके धातु में अपचयित करना।
गालक- अयस्क में उपस्थित अशुद्धि को पिघले रूप में हटाने और अपचयन में सहयोग हेतु मिलाये गये पदार्थ।
धातुमल - अशुद्धि (आधात्री) गालक।
द्रवण- कम गलनांक वाली धातुओं को परावर्तनी भट्टी में गर्म करके शोधित करना।
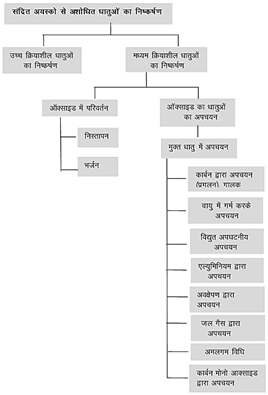
धातुओं का शोधन (Refining of Metals) - विभिन्न विधियों से प्राप्त धातुओं में अशुद्धियां होती हैं, जिन्हें परिष्कृत धातुएं (Crude Metals) कहते हैं। इन अशुद्धियों को हटाने के लिए परिष्कृत धातु का शोधन किया जाता है। धातु तथा अशुद्धि की प्रकृति के आधार पर शोधन की उपयोगी विधियां - (i) गलनिक पृथक्करण, (ii) आसवन विधि - यह विधि वाष्पशील धातुओं (जैसे- Zn, Hg, Cd, आदि) के शोधन के लिए प्रयुक्त की जाती है। (iii) मॉन्ड प्रक्रम, (iv) वॉन-आर्केल विधि, (v) विद्युतीय शोधन (Electrolytic refining) - उदाहरण- कॉपर का विद्युतीय शोधन ऐनोड, ब्लिस्टर कॉपर (98%), कैथोड, शुद्ध कॉपर विद्युत-अपघटî, \[CuS{{O}_{4}}\], 15% जलीय विलयन तनु \[{{H}_{2}}S{{O}_{4}}\]
क्यूपेलीकरण- अशुद्ध धातु को एक अण्डाकार पात्र जिसे क्यूपेल कहते हैं, में लेकर वायु की गर्म धारा में शोधित करते हैं। अमलगम- अशुद्ध धातु का पारे के साथ अमलगम बनाकर शोधन करना।
You need to login to perform this action.
You will be redirected in
3 sec
